MENINGITIS BACTERIANA:
Avances en el diagnóstico y tratamiento
Dr. Javier Eduardo Desse
Htal. De Enfermedades Infecciosas Francisco Javier Muñiz
Buenos Aires, Argentina
E-mail: jedesse@intramed.net.ar
La meningitis bacteriana ha sido reconocida por desde hace varios siglos como un gran síndrome en la literatura médica universal, encontrándose descripciones de la misma desde el siglo XVI.
Pero fue Viesseux, que en el año 1805 asoció esta patología a un cuadro con características epidémicas asociado a la presentación de un exantema purpúrico, mencionado como "fiebre purpúrica maligna" (meningococcemia con compromiso del sistema nervioso central).
ETIOLOGIA
El 75% a 80% de los agentes responsables incluyen: neisseria meningitidis, streptococcus pneumoniae, haemophilus influenzae (porcentaje que se adecúa según las áreas geográficas).
Bacterias y espiroquetas
Streptococcus pneumoniae
Neisseria meningitidis
Haemophilus influenzae
Streptococcus (grupo B)
Listeria monocytogenes
Treponema pallidum
Leptospiras
Staphylococcus aereus
Pseudomona aeruginosa
Bacilos gram negativos entéricos
Staphylococcus epidermidis
Propionibacterium acnesVirus
Echovirus
Coxsackie A y B
Enterovirus
Virus de la Parotiditis
Virus Herpes tipo I y II
Virus de Epstein Barr
Virus del HIV
Virus Herpes Zoster
Citomegalovirus
Virus de la encefalitis de California y ST. Louis
Virus de la fiebre por garrapatas del Colorado
Virus de la Coriomeningitis linfocitaria
PoliovirusParásitos
Naegleria
Angiostrongylus
Strongyloides stercolaris
(Etc.)
FISIOPATOLOGIA
A pesar de la existencia actual de distintos antibióticos para lograr una terapéutica eficaz, esta enfermedad puede constituirse, aún, en un cuadro potencialmente grave. La colonización de la nasofaringe ( interacción entre receptores del huésped y factores patogénicos bacterianos tales como: fimbrias, cápsula, etc los cuales son cruciales para el establecimiento del gérmen a nivel de los receptores de las células epiteliales) y la posterior invasión del agente infeccioso, constituyen la primera etapa , producto de la cual resulta en la invasión del huésped y la posterior diseminación para alcanzar el S.N:C (1).
Una vez alcanzado el territorio vascular los agentes bacterianos compiten con otros componentes del sistema inmunológico tales como: a) complemento, principalmente aquellos patógenos encapsulados, b) polimorfonucleares.
La activación de la cascada del complemento es escencial en la restricción del paso de las bacterias al sistema nervioso; esto se evidencia en aquellos individuos con déficit en algunos de los componentes de la cascada mencionada (C5, C6, C7, C8; particularmente relacionados con infecciones por neisseria meningitidis)(2).
Recientemente se ha relacionado el nivel de circulación del LPS meningocóccico con el grado de activación del complemento (3).
El sitio exacto de ingreso de los gérmenes al Sistema nervioso no se conoce (se postulan diferentes lugares: plexos coroideos, lámina cribosa, asociados a monocitos circulantes, etc. ).
Una vez ingresado el agente al sistema nervioso se produce una bacteriemia secundaria, resultante del proceso supurativo en dicho compartimiento perpetuando de esta manera el proceso infeccioso. Varios son los productos bacterianos (ej: acido teicocico, lipopolisacáridos, pared celular del S. pneumoniae) que poseen actividad antigénica para desencadenar la cascada de la inflamación, particularmente luego de la acción deletérea de los antimicrobianos. Esta respuesta, que en muchas situaciones puede ser perjudicial para el individuo, puede ser atenuada con drogas que inhiben la via de la ciclooxigenasa del metabolismo del acido araquidónico (4).
Es así, que el uso concomitante de agentes antiinflamatorios asociada a la terapéutica antimicrobiana específica mejora el pronóstico de los pacientes con Meningitis bacteriana aguda, a través de una reducción en la respuesta inflamatoria a nivel del sistema nervioso central.
La presencia bacteriana altera la permeabilidad de la barrera hemato-encefálica, comprobado por varios estudios, en los cuales se demostró la permeabilidad de proteínas (albúmina), que habitualmente no atraviesan la barrera. Los Lipopolisacáridos de los Gram negativos también aumentan la permeabilidad de la barrera por un efecto, aparentemente, citotóxico a nivel del endotelio microvascular cerebral.
El edema cerebral vasogénico, citotóxico y/o intersticial, contribuye a un aumento en la presión intracraneal con las consecuentes complicaciones.
DIAGNOSTICO
Los avances relacionados al diagnóstico de la Meningitis bacteriana aguda se relacionan con los métodos complementarios, especialmente aquellos obtenidos a través del análisis del L.C.R.
a) presión de apertura
Este paso no siempre es respetado en todos los casos pero es de suma importancia para el manejo clínico del paciente. El valor normal no debe sobrepasar los 180 mm h2o en decúbito lateral. Es común observar en esta patología valores entre 200 mmh2o y 500 mmh20.
b) apariencia
Normalmente es clara. La presencia de valores >200 leucocitos/mm3 y/o >400 hematíes/mm3 y/o >105 UFC: de colonias bacterianas y/o elevada concentración de proteínas, enturbian el L.C.R.
La xantocromía está relacionada al color amarillento, / amarillento-anaranjado en el sobrenadante luego del centrifugado. En los casos de Meningitis bacteriana aguda la elevada concentración de las mismas (proteínas > 150 mg./dl) justifican dicha apariencia (2).
c) glucorraquia
La concentración normal de glucosa en L.C.R es >45 mg./dl. Una concentración <40 ng./dl ocurre en el 60% de los pacientes con esta patología(3).
El verdadero valor de la glucorraquia se obtiene a través de la correlación con los niveles sanguíneos.
Coeficientes menores a 0.31 se considera hipoglucorraquia, siendo una de las causas una infección bacteriana (descartar otras etiologías).
d) proteinorraquia
Valores superiores a 50 mg./dl se lo considera patológico. Cuando la punción lumbar fue de carácter traumático ( presencia de hematíes), el valor debe ser corregido: 1 mg./dl de proteínas por cada 100 hematíes.
e) Recuento de leucocitos
Para el análisis cuidadoso del recuento de leucocitos debe procesarse la muestra adecuadamente de manera precoz. Habitualmente el valor hallado es entre 0 – 5 leucocitos por campo (mononuclerares).
Valores mayores a los expuestos correlacionan con una posible patología infecciosas de tipo bacteriana (según contexto de la enfermedad), recordando que las infecciones virales cursan con un aumento de leucocitos del tipo polimorfonucleares en las primeras horas de la presentación del cuadro.
d) Técnica de Gram
La técnica de Gram es un elemento de suma utilidad, indispensble para establecer un tratamiento dirigido al agente etiológico recuperado en la misma.
Presenta una sensibilidad del 60% al 90% (relacionado con una concentración bateriana >105 UFC / ml.).
e) Cultivo
La ventaja de implementar este procedimiento sistemáticamente, se relaciona con el uso adecuado de antibióticos y la posibilidad de determinar el patrón de la sensibilidad a los mismos. La sensibilidad ronda el 80%. Requiere no menos de 24 hs, para la identificación de los gérmenes.
f) Dosaje de lactato
El dosaje de ácido láctico ha demostrado ser útil para diferenciar las distintas etiologías (bacteriana, viral,). Cabe destacar que NO debe utilizarse este parámetro como único indicador para establecer el diagnóstico etiológico, si bien nos proporciona un dato a favor de una probable etiología bacteriana del cuadro, como así tambiénen aquellos pacientes parcialmente tratados, en los cuales el rescate del gérmen no es posible(1) (4).
g) Serología
Las técnicas basadas en la detección de polisacáridos capsulares tienen la ventaja de:
- no dependen de la presencia de bacterias viables para obtener resultados positivos.
- Son especialmente útil en aquellos casos con técnica de Gram negativo, donde se hace difícil el diagnóstico etiológico (meningitis parcialmente tratadas).
Habitualmente son test simples de realizar, con amplia dsponibilidad en los distintos laboratorios y no requieren de personal especializado para ejecutarlos, especialmente : técnica de látex y coaglutinación.
| Sensibilidad | Gérmenes | |
| Latex | 81% - 100%
50% - 69% 30% - 70% |
H.influenzae
S. pneumoniae N. meningitidis |
| Coaglutinacion | 71% - 83%
0% -90% 17% - 100% |
H. influenzae
S. pneumoniae N. meningitidis |
| C.I.E | 67% - 85%
50% - 100% 50% - 90% |
H. influenzae
S. pneumoniae N. meningitidis |
h) Proteína C reactiva:
Es un reactante de fase aguda que también ayuda en el diagnóstico de esta patología a través de la distinción entre meningitis de origen bacteriano y las demás etiologías, ya que se observa mayores concentraciones cuando la causa es de origen bacteriano. Un resultado negativo prácticamente excluye dicho origen (bacteriano) con un 99% de seguridad(7) (8).
I) PCR
Si bien existen trabajos en los cuales se ha utilizado el método para el diagnóstico de distintos gérmenes (H. Influenzae, N. Meningitidis, ets.) con una sensibilidad y especificidad cercana al 90%, todavía faltan ensayos a gran escala para
estandarizar el método por la presencia de falsos positivos, y por la ausencia de una mayor disponibilidad debido a su costo(9).
j) Adenosin deaminasa (ADA)
En casos de Meningitis bacteriana cuya etiología es relacionada con el M. tuberculosis, el dosaje de ADA es de suma utilidad asociado a una sensibilidad cercana al 50% y una especificidad cercana al 100%.(10).
Neuroimágenes
La utilización de métodos tales como: Tomografía Axial Computada, Resonancia Magnética Nuclear, etc. No aportan datos relevantes para arribar al diagnóstico de esta enfermedad.
Dichos métodos son de suma utilidad en el diagnóstico de complicaciones supuradas (ej: abscesos cerebrales), y la relación costo/beneficio supone no
realizarlos de rutina con el fin de arribar al diagnóstico de esta enfermedad; la utilidad radica en descartar contraindicaciones para la realización de la punción lumbar obligatoria como medio de diagnóstico de la meningitis bacteriana.
TRATAMIENTO
El tratamiento de la Meningitis bacteriana apunta a la erradicación del gérmen del líquido cefalorraquídeo. Los antibióticos seleccionados deben tener determinadas condiciones, las cuales podemos sintetizar en: habilidad para penetrar en el sistema ventricular (pasaje a través de la barrera hemato-encefálica), actividad en medio ácido (purulento), bajo nivel de clearence de dicho compartimiento (lograr concentraciones adecuadas por largo período).
A pesar de que las características farmacocinéticas influyen sobre la actividad final del antibiótico, uno de los factores más importantes que rigen la misma es la permeabilidad de la barrera hematoencefálica (11).
Una vez que la droga alcanza el L.C.R deben confluir ciertos factores para alograr resultados óptimos: concentración suficiente de droga libre en L.C.R, concentración que supere la concentración bactericida mínima por 10 a 20 veces, ausencia de antagonismo antibiótico(12).
El tratamiento de la Meningitis bacteriana puede enfocarse en base a dos aspectos:
- tratamiento empírico
- tratamiento específico según agente etiológico.
Tratamiento empírico según grupo etario y/o factores asociados
Edad Antibiótico
0 a 4 semanas de vida Ampicilina (+) Cefalosporina de 3ª generación (na)
ó Aminoglucósido.
4 a 12 semanas de vida Ampicilina (+) Cefalosporina de 3ª generación (na)
3 meses a 18 años Cefalosporina de 3ª generación ó
Ampicilina (+) Cloranfenicol.
18 años a 50 años Ceftriaxone con/sin Ampicilina (*)
post traumatismo craneoencefálico Ceftriaxone
post neurocirugía Vancomicina (+) Cefalosporina 3ª generación (as)
(as) antipseudomónica
(na) no antipseudomónica
(*) el agregado de Aampicilina se relaciona con la sospecha de la presencia de Legionella Pnemophila.
Duración del tratamiento antimicrobiano según gérmen implicado (*)
N. meningitidis......................7 dias
H. influenzae.........................7 a 10 dias
S. pneumoniae....................10 a 14 dias
Bacilos gram negativos (otros).....21 dias
(*) datos orientativos.
TERAPEUTICA ADYUVANTE
La administración de antibióticos en los cuadros de meningitis bacteriana trae aparejada la destrucción del gérmen, hecho que se relaciona con la liberación de estructuras altamente antigénica como es el caso de los Lipopolisacáridos de las bacterias gram negativas, la respuesta desencadenada puede resultar nociva para el propio tejido del huésped.
La dexametasona es uno de los agentes mas estudiados para prevenir dichas complicaciones, aunque ha generado muchas controversias ( I.D.S.A 1993) a favor (13) y en contra de su uso(14) (15) (16)
La ventaja del uso de los corticoides en el tratamiento de la meningitis bacteriana, administrado previamente a la infusión de los antibióticos (por un lapso de 48 hs. A 72 hs.) reduce la tasa de complicaciones (ej: hipoacusia/sordera, en casos de H. Influenzae). En contrapartida, trabajos recientes ponen en duda la eficacia de esta droga (17) (18).
Desde el año 1988 se han realizado diversos estudios clínicos sobre terapéutica coadyuvante con el uso de corticoides (dexametasona).El diseño de algunas investigaciones arrojan ciertas dudas; es así que la interpretación y/o comparación de los resultados no puede poner fin a esta disyuntiva.
En una reciente conferencia, el Dr. George McCracken enfatizó que es fundamental el momento de la administración de la dexametasona como coadyuvante en la terapéutica de esta patología: se debe iniciar antes ó en su defecto junto a la terapéutica antibiótica, para tratar de impedir una mayor
concentración de Factor de Necrosis Tumoral-alfa, uno de los mas importantes mediadores en la respuesta inflamatoria(19) (20). Si bien actualmente no cabe duda la adopción a favor de la dexametasona en los pacientes pediátricos, no ocurre lo mismo en los adultos, donde solamente un estudio evalúa a este a grupo etario(21). La mayoría de los estudios focaliza su atención en pacientes pediátricos; no existen recomendaciones formales para su uso en pacientes adultos.
De todos modos, es razonable considerar la administración de terapéutica coadyuvante en ello también, principalmente en aquellas situaciones donde se demuestren la presencia de gérmenes en el Gram (L.C.R), dado que refleja una elevada concentración bacteriana en dicho sitio (22); otras posibles indicaciones se basan en la presencia da indicadores de mal pronóstico como: a) alteración de la conciencia, hipertensión endocraneana, y edema cerebral.
La dosis recomendada es: 0.6 mg/kg/dia en cuatro dosis por 48 hs., ó 0.8 mg/kg/ dia en dos dosis.
NEUMOCOCO RESISTENTE (PENR) : EL GRAN DESAFIO...
La historia del neumococo resistente a los antibióticos data del año 1917 durante la terapia con optoquina en un paciente con neumonía. Este antibiótico tuvo una utilización limitada por sus efectos adversos(23).
En la década del cuarenta se demostró resistencia intratratamiento a las sulfas en pacientes con meningitis y se seleccionaron mutantes de laboratorio resistentes a la penicilina. La primera cepa de neumococo Pen R como tal, fue identificada en un paciente australiano portador de una hipogammaglobulinemia (CIM 6.0 Ugr/ml)
a comienzos de la década del setenta. En Nueva Guinea y Sudáfrica se registraron casos en esos mismos años, en este último con reportes superiores al 20%. El primer caso que se informa en USA es en el año 1974. Luego, las cepas de Neumococo PenR se expandieron por España, Francia, Hungría, Islandia y otros países europeos y asiáticos (24); en España el 25% al 35%, en Hungría el 55% y en Sudáfrica el 23% de los aislamientos de Neumococo PenR corresponden a resistencias de alto nivel.
Aquellos países con un control estricto sobre la utilización de antimicrobianos como Finlandia y Bélgica, los cuales cuentan con un sistema de vigilancia, presentan cifras de Neumococo PenR inferiores al 2% en general. La cifra media de resistencia en nuestro país es del 20%, porcentaje similar al comunicado por USA, Alemania y Suecia.
El Neumococo puede ser portado tan temprano como el primer dia de vida. La media de edad para la primera detección del mismo es a los 6 meses. La primera adquisición se asocia con un aumento en el riesgo de desarrollar enfermedad clínica. Los serogrupos 6,14, 19 y 23 –aqueelos vinculados con PenR- corresponden a los 2/3 de los Neumococos aislados durante los dos primeros años de vida. Se asocian frecuentemente con bacteriemia y otitis media en los niños y son poco comunes en los adultos.
La portación prolongada y la rápida readquisición, aumenta las chances de exposición de estas cepas a los antibióticos y, por lo tanto, de condicionar un importante factor selectivo para el desarrollo de resistencia.
La distribución del Neumococo resistente a nivel mundial, especialmente en determinadas áreas donde la prevalencia es mayor ha llevado a considerar este fenómeno dentro del grupo de las llamadas enfermedades emergentes.
El reconocido rol de la presión selectiva por el uso inadecuado de antibióticos en la adquisición y aumento de dicha resistencia hace reflexionar a la comunidad médica sobre la importancia de contar con conocimientos sólidos que permitan resolver de manera conveniente infecciones por este gérmen, por el cual contamos con adecuados antimicrobianos y la vacuna 23-valente.
SITUACIONES EN LAS CUALES ESTA RECOMENDADA LA APLICACIÓN DE LA VACUNA 23-VALENTE ( The Advisory Commite on Inmunization Practices – USA -)
Edad mayor a 65 años
Alcoholismo
Linfomas
Transplantados
Enfermedad cardiovascular cronica
Cirrosis
Mieloma múltiple
Enfermedad por HIV
Enfermedad pulmonar crónica
Fístula de L. C. R.
Insuficiencia renal crónica
Diabetes
Esplenectomía
Sindrome nefrótico
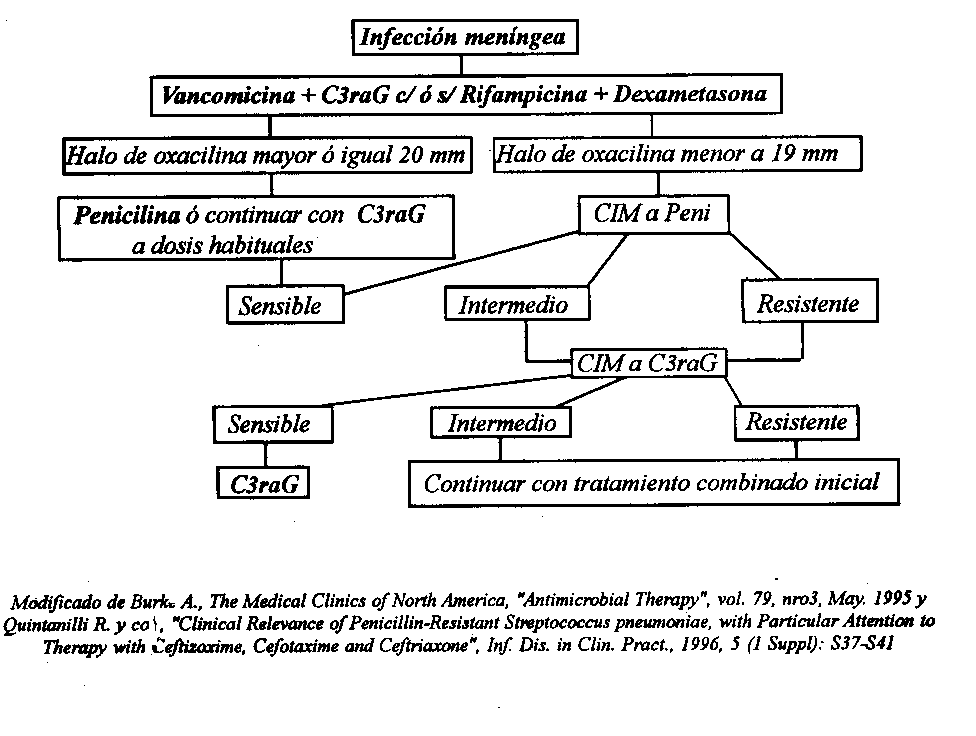
A continuación se propone un esuqema terapéutico frente a una infección del SNC por Neumococo PENR:
TRATAMIENTO DE NEUMOCOCO –PENR-
BIBLIOGRAFíA
- Dougherty JM, Roth RM. Cerebral spinal fluid: Emerg Med Clin North Am, 1986;4:281-297.
- Conly JM, Ronald AR. Cerebrospinal fluid as a diagnostic body fluid: Am J Med,1983;75:102-107
- Marton KI, Gean AD. The spinal top: a new look at an old test. Ann Intern Med;1986104:840-848.
- Lanningan R, MacDonals MA, et al. Evaluation of cerebrospinal fluid lactic acid levels as an aid in differential diagnosis of bacterial and viral meningitis in adults:J Clin Microb 1980;11:324-327.
- Spanos A, Harell Fe Jr., Durack DT. Differential diagnosis of acute meningitis. Analysis of predictive values of initial observations. JAMA 1989;262:2700-2707.
- Kaplan SL, O brian Smith E, et al. Association between preadmission oral antibiotic therapy and CSF findings and sequelae caused by Haemophilus influenzae type b meningitis: Ped Infec Dis 1986;5:626-632.
- Gray BM, Simmons DR, et al. Quantitative levels of c-reactive protein in cerebrospinal in patients with bacterial meningitis and other conditions: J Pediatrics 1986;108:665-670.
- Abramson JS, Hampton KD, Babu S et al. The use of c-reactive protein from cerebrospinal fluid for differentiating meningitis from other central nervous system diseases: J Infect Dis 1985;151:854-858.
- Kristiansen BE, Jenkis A , et al. Rapid diagnosis of meningococcal meningitis by polymerase chain reaction: Lancet 1991;337:1568-1569.
- Lopez-Cortez LF, Cruz-Ruiz M, et al. Adenosine Deaminasa activity in the CSF of patients with aseptic meningitis:utility in the diagnosis of Tuberculous meningitis or neurobrucellosis: Clin Inf Dis 1995;20:525-530.
- Papastamelos AG, Tunkel AR. Antibacterial agents in infections of the central nervous system and eye: Infect Dis Clin North Am 1995;9:615-637.
- Tunkel AR, Wispelwey B, Scheld WM: Bacterial meningitis: recent advances in pathophysiology and treatment: Ann Int Med1990;112:610-623.
- Schaad , Kaplan S, et al. Steroid therapy for baacterial meningitis: Clin Inf Dis 1995;20:686-690.
- Lebel MH, Freij BJ, et al: Dexametasone therapy for bacterial meningitis:results of two double-blind, placebo controlled trials NEJM 1988;319:964-971.
- Odio Cm, Faingezicht I, et al. The beneficials effects of early dexamethasone administration in infants and children with bacterial meningitis: NEJM1991;324:1525-1531.
- Girgis NI, Farid Z, Mikhil IA, et al. Dexamethasone treatment for bacterial meningitis in children and adults: Ped Infect Dis J 1989;8:848-851.
- King Sm, Lawb, et añ. Dexamethasone therapy for bacterial meningitis: better never than late? Can J Infect Dis 1994;5:219-225.
- Wald ER, Kaplan SL, et al. Dexamethasone therapy for children with bacterial meningitis: Pediatrics 1995,95:21-21.
- McCracken GH, Jr.:2nd. International Pediatrics infections Disease Conference; Napa Valley, Ca. Sept 16-19,1997. Infect Dis In Children 1997;10(12):9-10.
- McIntyre PB, Berkey CS, et al. Dexamethasone as adjuntive therapy in bacterial meningitis. A meta-analysis of randomized clinical trials. JAMA 1997;278:952-931.
- Girgis NI, Farid Z, et al. Dexamethasone treatment for bacterial meningitis in children and adults: Ped Inf Dis J 1989;8:848-851.
- Townsend GC, Scheld WM: Adjuntive cortecosteroids for adults bacterial meningitis: Infect Med 1995;12:707-710.
- Klugman KP. Pneumococcal Resistance to Antibiotics: Antimicrob Agents Chemother 1992;36:1703-1707.
- Appelbaum PC, et al. Activities of oral and parenteral agent penicilin-suceptible and resistent pneumococci: Antimicrob Agents Chemoth 1995;39:1449-1504.